∆H = HP – HR
HR = entalpi reaktan (R)
HP = entalpi produk (P)
Satuan energi adalah joule (J). Satuan itu diturunkan dari definisi energi kinetik, yaitu
Ek = mv². Jadi, 1 joule sama dengan 1 kg m2/s², setara dengan energi yang dimiliki suatu objek bermassa 1 kg dan bergerak dengan kecepatan 1 m/s. Namun, untuk merujuk energi yang terlibat dalam reaksi kimia yang secara kuantitas berukuran mol, sering digunakan satuan yang lebih besar, yaitu kilojoule (kJ), 1 kilojoule = 1.000 joule (1 kJ = 1.000 J). Semua bentuk energi dapat diubah menjadi kalor. Dengan kata lain, pengukuran energi dilakukan dalam bentuk kalor. Untuk mengungkap kalor, kadang-kadang digunakan satuan kalori (disingkat cal, dari calorie). Satu kalori didefinisikan sebagai jumlah kalor yang diperlukan oleh 1 gram air untuk menaikkan suhu dari 15°C ke 16°C. Perlu Anda ketahui bahwa besar kalor yang diperlukan oleh 1 gram air untuk menaikkan suhu 1°C adalah beragam. Misalnya, pada suhu 25°C, diperlukan kalor 0,998 kalori untuk menaikkan suhu 1 gram air sebesar 1 °C.
Seperti joule, kilokalori (kcal) merupakan satuan untuk menyatakan perubahan energi kimia. Dalam ilmu gizi, kandungan energi dalam makanan digunakan satuan Kalori (Cal. C kapital). Satuan itu sama dengan kilokalori. Akan tetapi, penggunaan satuan kalori untuk menyatakan kalor harus disesuaikan dengan SI (satuan internasional). Menurut SI, kalor dinyatakan dengan satuan joule. Hubungan antara kalori dan joule adalah sebagai berikut.
1 kalori = 4,184 joule
1 kilokalori = 4,184 kilojoule
Besar perubahan entalpi dapat ditentukan dengan empat cara, yaitu dengan melakukan eksperimen, dengan hukum Hess, dengan data perubahan entalpi pembentukan standar, dan dengan data energi ikatan.
1. Menentukan ∆H dengan Eksperimen Sederhana
Perubahan entalpi dapat ditentukan apabila Anda telah mengetahui
kapasitas panas, kalor jenis, dan kalorimetri.
a. Kapasitas Panas dan Kalor Jenis
Pada pembahasan di depan telah Anda pelajari definisi kalori, yaitu ukuran perubahan suhu yang dialami air jika menyerap atau membebaskan sejumlah kalor. Secara umum, ukuran perubahan itu dapat disebut kapasitas panas. Kapasitas panas didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan suhu sebesar 1 °C.
Kapasitas panas merupakan sifat ekstensif, maksudnya sifat yang bergantung pada ukuran. Misalnya, untuk menaikkan 1°C air 10 gram diperlukan energi 10 kali lebih besar daripada jika digunakan untuk menaikkan 1°C air 1 gram.
Sifat intensif yang berhubungan dengan kapasitas panas adalah kalor jenis (specific heat capacity, c). Kalor jenis didefinisikan sebagai jumlah kalor yang diperlukan untuk menaikkan suhu 1 gram zat sebesar 1°C. Oleh karena itu, kalor jenis dinyatakan dengan satuan Jg-1°C-1.
Entalpi pembakaran dapat ditentukan menggunakan energi panas (kalor) yang dilepaskan dalam reaksi perubahan untuk memanaskan air dengan volume tertentu. Energi panas tersebut menaikkan suhu air. Energi panas yang dipindahkan ke air dapat ditentukan dengan persamaan berikut.
Qlarutan= m x c x ∆T
Qkalorimeter = C x
∆T
Contoh Soal
Berapa joule panas diperlukan untuk
menaikkan suhu air yang massanya 100 g dari 25°C ke 100°C ? Kalor jenis air 4,2
Jg-1°C-1.
Q = m x c x ∆T
Q = 100 g x 4,2 Jg-1°C-1×
75°C
Q = 31.500 J
Q = 31,5 kJ
b. Kalorimetri
Dalam suatu reaksi kimia, perubahan energi selalu dapat dinyatakan sebagai kalor. Alat yang digunakan untuk mengukur kalor reaksi disebut kalorimeter. Ada dua macam kalorimeter, yaitu kalorimeter bom dan kalorimeter termos.
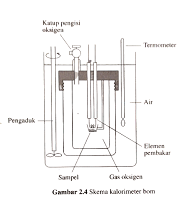
Kalorimeter bom terdiri atas suatu wadah baja yang kuat (bom) yang ditempati reaktan (pereaksi). Kemudian, bom itu diletakkan dalam penangas air yang disekat (diisolasi) serta dilengkapi dengan pengaduk dan termometer. Suhu awal penangas dan pereaksi dalam bom diukur. Setelah terjadi reaksi, kalor yang dibebaskan diserap oleh bom dan penangas air sehingga suhu alat secara keseluruhan terukur. Sebelum digunakan, kapasitas panas alat harus diukur terlebih dahulu dalam suatu eksperimen tersendiri.
Kalorimeter bom dapat digunakan untuk
pengukuran yang sangat cermat. Secara sederhana, skema kalorimeter bom seperti
gambar di samping.
2) Kalorimeter Termos
Kalorimeter termos kadang-kadang disebut kalorimeter gelas kopi. Disebut demikian karena kalorimeter termos menggunakan gelas kopi yang dibuat dari bahan stirobusa untuk mewadahi reaktan. Asas penggunaan kalorimeter termos sama dengan kalorimeter bom. Mula-mula reaktan direaksikan dalam gelas kopi. Kalor reaksi akan mengubah suhu campuran reaksi. Setelah reaksi sempurna, suhu akhir diukur. Reaksi lengkap ditandai dengan suhu maksimum yang terbaca oleh termometer. Dari perubahan suhu dan nilai kapasitas panas campuran reaktan, besar kalor reaksi dapat diperkirakan. Untuk menentukan perubahan entalpi reaksi, lakukan kegiatan berikut.
Eksperimen Perubahan Entalpi Reaksi
Tujuan:
Menentukan perubahan entalpi dari reaksi natrium hidroksida dan asam klorida yang menghasilkan satu mol air sesuai dengan reaksi: NaOH(aq) + HCl(aq) ® NaCl(aq) + H2O(l)
a. Alat dan Bahan
1. Gelas plastik 250 mL (1
buah)
2. Gelas ukur 100 mL (2 buah)
3. Termometer 0-100°C (1
buah)
4. Larutan NaOH 1 M (50 ml)
5. Larutan HCI 1 M (50 ml)
b. Cara Kerja
1.
Ukurlah suhu larutan NaOH dan HCI sebelum direaksikan. Termometer
harus dibersihkan dan dikeringkan sebelum digunakan untuk mengukur suhu larutan
yang berbeda.
2.
Masukkan larutan NaOH dan larutan HCI dalam gelas plastik.
Kemudian, ukurlah suhunya.
c. Pertanyaan
1.
Mengapa termometer harus dibersihkan dan dikeringkan sebelum
digunakan untuk mengukur suhu larutan lain?
2.
Bagaimanakah cara menentukan perubahan entalpi dari kegiatan ini
setelah suhu awal dan suhu campuran terukur?
3.
Jika suhu awal tidak sama, bagaimanakah cara Anda untuk
mengatasinya?
Contoh Soal
Dalam suatu eksperimen, 0.1 gram H2 dan 0,8 gram O2 dimampatkan dalam bom berukuran 1 liter. Kemudian, bom itu diletakkan dalam sebuah kalorimeter yang berkapasitas 9.08x104J/oC. Suhu awal kalorimeter adalah 25°C dan suhu akhirnya 25,155°C.Hitunglah banyaknya kalor yang dibebaskan per mol H2O yang terbentuk.
Jawaban:
Kalor yang dibebaskan
Q = C x ∆T
Q = (9,08.10⁴ J/1oC) x 0.155oC
Q = 1.41x104 J
Q = 14,1 kJ
Reaksi antara H2 dan O2 membentuk air adalah 2H2 + O2 ® 2H2O
Jumlah H2O yang terbentuk dalam reaksi jika dinyatakan dengan mol adalah
0,1 g H2 x (1 mol H₂ / 2 g H₂) = 0.05 mol H2O.
Jadi, besar kalor yang dibebaskan per mol H2O yang terbentuk
adalah
14,1 kJ / 0,05 mol H₂O = 282 kJ
Etanol (Mr = 46) dengan massa 1,5 gram dibakar dalam kalorimeter berisi 500 gram air. Jika terjadi peningkatan suhu air sebesar 19,5°C.
Tentukan entalpi pembakaran etanol (Cair = 4,1 Jg-1oC).
Jawaban:
Panas yang dibebaskan:
Q = m x c x ∆T
Q = 500 x 4,2 x ∆T
Q = 40,95 kJ
Jumlah etanol yang terbakar = 1,5/46 = 0.03 mol
Entalpi pembakaran = 40,95 : 0,03 = 1.365 kJ/mol.


Tidak ada komentar:
Posting Komentar